水解反应的热效应解析(分析水解反应的热效应
摘要:水解反应是化学中常见的反应类型之一,具有重要的理论和实际意义。水解反应的热效应是其重要的特点之一,可以体现化学反应时涉及到的能量变化。热效应的大小和方向性取决于反应前后的能量差,它可以通过实验测量来确定。反应物浓度、温度、压力和物质性质等都会影响水解反应的热效应。研究和应用水解反应的热效应对于研究化学反应的动力学、理解物质结构和制冷技术等都有重要意义。
水解反应的热效应解析
水解反应是指在水中发生的化学反应,其中水充当溶液和媒介,影响反应进程和反应动力学。水解反应是化学中常见的反应类型之一,具有重要的理论和实际意义。其中一个重要的特点是它的热效应,即反应时释放或吸收的热能。
水解反应的定义
水解反应是指物质在水中与水发生反应,形成物质的离子、分子或氢氧化物。水解反应通常是酸碱反应或盐的离解反应。
在水中,许多离子和分子都会水解,例如碳酸根离子(CO32-)、氨(NH3)、亚硝酸根离子(NO2-)、铁离子(Fe2+)和铜离子(Cu2+)等。
以碳酸根离子(CO32-)的水解反应为例:
CO32- + H2O ? HCO3- + OH-
HCO3- + H2O ? CO2 + H3O+
上述水解反应是碳酸盐体系在水中的两步反应。在第一步中,碳酸根离子会水解成为碳酸氢根离子(HCO3-)和氢氧根离子(OH-)。在第二步中,碳酸氢根离子会继续水解,产生二氧化碳(CO2)和氢氧离子(H3O+),H3O+即为酸性离子。
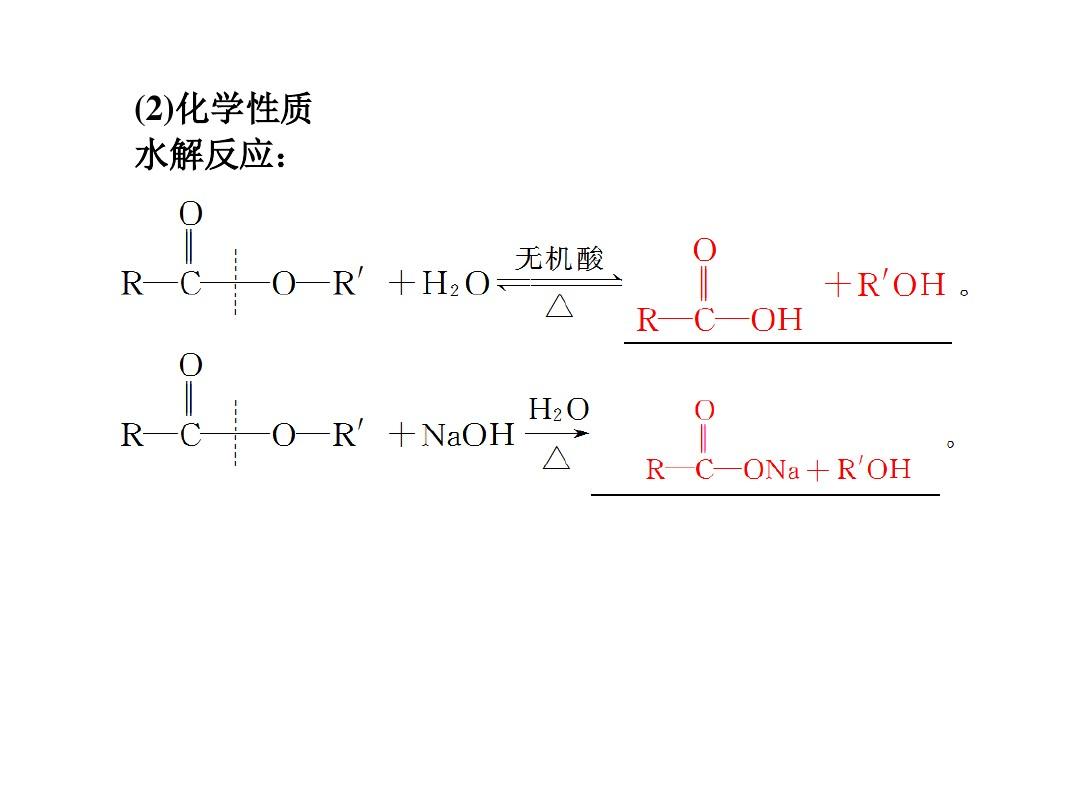
水解反应的热效应
水解反应的热效应是指物质在水中水解时放出或吸收的热量。这个热量是由化学键的断裂和形成引起的,可以在实验中通过测量反应前后系统的温度变化来确定。水解反应的热效应可以是放热反应或吸热反应,其方向性取决于反应前后的能量差。
通常情况下,水解酸盐和水解碱盐的水解反应都是放热反应,因为它们在水中水解后会释放出热能,使反应体系温度升高。例如,氨(NH3)和氯化铵(NH4Cl)的水解反应:
NH3 + H2O → NH4+ + OH- (放热反应)
NH4Cl + H2O → NH4+ + Cl- (无热效应)
在上述反应中,NH3和NH4Cl均与水发生水解反应,但它们的热效应不同。NH3和水的水解反应中释放出热能,使体系温度升高,而NH4Cl水解后不释放或吸收热能,因而没有温度变化。
另外,有些水解反应是吸热反应,它们在水中水解后会吸收热能,使反应体系温度降低。例如,硝酸铵(NH4NO3)的水解反应:
NH4NO3 + H2O → NH4+ + NO3- (吸热反应)
在这个反应中,NH4NO3水解后会吸收热能,使反应体系温度降低。这个现象被广泛应用于制冷技术。
热效应的影响因素
水解反应的热效应与化学反应时涉及到的反应物浓度、温度、压力和物质性质等相关。反应物浓度的增加会加快化学反应,因此也会增加热效应量。温度的升高会加速化学反应的速率和热效应的量,因为热能可以促进反应物分子的运动,从而增加反应概率。
压力对水解反应的热效应影响不大,但在一些特定情况下可以起到作用。例如,硫酸铜(CuSO4)在水中的溶解与水解,可以吸收环境中的水分,释放热能,增加体系温度。
物质性质对水解反应的热效应也有很大影响。不同的物质之间在同样条件下水解所产生的反应热可以不同,原因在于它们的化学结构不同。化学键类型、键能和电子构型等因素都会影响水解反应的热效应。
因此,某些物质在水中水解的热效应可以用来确定物质的化学性质和结构。
结论
水解反应是化学中常见的反应类型之一,具有重要的理论和实际意义。水解反应的热效应是其重要的特点之一,可以体现化学反应时涉及到的能量变化。热效应的大小和方向性取决于反应前后的能量差,它可以通过实验测量来确定。
反应物浓度、温度、压力和物质性质等都会影响水解反应的热效应。研究和应用水解反应的热效应对于研究化学反应的动力学、理解物质结构和制冷技术等都有重要意义。
【相关文章】






